Uso off-label
Martina Feichter ha studiato biologia con una materia elettiva farmacia a Innsbruck e si è anche immersa nel mondo delle piante medicinali. Da lì non era lontano da altri argomenti medici che la affascinano ancora oggi. Si è formata come giornalista presso l'Axel Springer Academy di Amburgo e lavora per dal 2007 - prima come redattrice e dal 2012 come scrittrice freelance.
Maggiori informazioni sugli esperti di Tutti i contenuti di sono controllati da giornalisti medici.
Nell'uso off-label, i farmaci vengono utilizzati al di fuori della loro approvazione ufficiale. Se, ad esempio, il medico prescrive a un bambino un antibiotico approvato solo per gli adulti, lo fa "off label". Qui puoi scoprire quali possono essere le ragioni dell'uso off-label e quali sono i rischi ad esso associati!

Cosa significa "uso off-label"?
Il termine inglese "uso off-label" significa "uso improprio" o "uso non approvato". Ciò significa l'uso di un farmaco contro disturbi o malattie o in determinati gruppi di pazienti per il cui trattamento il farmaco in questione in realtà non ha l'approvazione delle autorità regolatorie.
L'ingresso è strettamente regolamentato
Tale approvazione, ovvero l'approvazione, è richiesta per ogni farmaco: se un'azienda farmaceutica ha sviluppato un nuovo farmaco, deve comunque essere approvato dalle autorità, ovvero controllato e approvato. L'autorità competente per il rilascio delle licenze per la maggior parte dei farmaci in Germania è l'Istituto federale per i farmaci ei dispositivi medici (BfArM). Per alcuni farmaci (come i vaccini), tuttavia, il Paul Ehrlich Institute (PEI) deve concedere l'approvazione.
Tale approvazione è valida solo per una specifica area di applicazione - per una specifica malattia o un sintomo specifico e un gruppo specifico di persone (ad esempio emicrania acuta con o senza aura negli adulti). Nell'approvazione sono specificati anche il tipo di applicazione del farmaco (ad es. come compressa o siringa sottocutanea), il dosaggio e la durata dell'uso.
Un produttore può richiedere sin dall'inizio diverse approvazioni per il suo farmaco, ovvero per diverse aree di applicazione. Oppure può richiedere un'estensione di un'approvazione esistente, ad esempio affinché in futuro un farmaco antinfluenzale per adulti venga approvato anche per i bambini.
Per ogni area di applicazione richiesta, l'azienda farmaceutica deve presentare i risultati dello studio alle autorità regolatorie che dimostrino l'uso efficace e sicuro del farmaco in questa area di applicazione e in questa forma.
Uso off-label in determinate condizioni
In pratica, però, alcuni farmaci si rivelano utili anche per disturbi, malattie o gruppi di persone diversi da quelli consentiti. Il produttore potrebbe quindi richiedere l'approvazione anche per questi campi di applicazione. Tuttavia, poiché questo è molto costoso e richiede tempo, le aziende farmaceutiche spesso ne fanno a meno.
Così accade che i medici utilizzino molti farmaci al di fuori della loro approvazione ("off label") a determinate condizioni. I medici usano questo uso off-label, ad esempio, quando una malattia non può essere adeguatamente trattata con i farmaci approvati per loro, ma un farmaco che non è stato approvato ha mostrato efficacia qui.
Uso off-label: la situazione giuridica
Ogni medico è sostanzialmente autorizzato a prescrivere farmaci al di fuori della rispettiva approvazione. Dovrebbe farlo anche se, dal suo punto di vista professionale, la preparazione in questione è la migliore opzione di trattamento per un particolare paziente. Tuttavia, per essere sicuri, le società mediche raccomandano l'uso off-label ai professionisti medici solo se studi scientifici hanno dimostrato che il farmaco è efficace anche nel campo di applicazione non approvato.
Se il medico volesse prescrivere un farmaco "off label", è tenuto ad informare attentamente il paziente: deve precisare che il farmaco in questione non è approvato per l'uso previsto. Il medico deve inoltre informare il paziente sulle possibili alternative, sull'andamento del trattamento programmato e sulle possibili conseguenze e rischi.
Responsabilità per effetti collaterali
Se i medici prescrivono un farmaco come previsto (cioè nel dosaggio raccomandato) nell'ambito della sua approvazione e il paziente manifesta gravi effetti collaterali, il produttore ne è responsabile.
La situazione è diversa con l'uso off-label: se il medico prescrive un farmaco al di fuori dell'approvazione, può essere ritenuto responsabile di gravi effetti collaterali. Di norma, l'azienda farmaceutica non si assume alcuna responsabilità in questo caso.
Esistono tuttavia delle eccezioni: ad esempio, alcuni produttori di farmaci contenenti acido valproico hanno riconosciuto l'uso off-label del loro preparato per la prevenzione dell'emicrania - e quindi si sono anche assunti la responsabilità di tale uso.
Uso off-label: rischi
L'efficacia di un farmaco al di fuori delle aree di applicazione approvate per lo più non è stata studiata scientificamente e dimostrata in dettaglio. Spesso mancano anche dati scientifici affidabili sui possibili effetti collaterali e rischi, soprattutto in relazione all'uso off-label (i dati generali sugli effetti indesiderati di un farmaco, però, risultano solitamente dagli studi delle prime approvazioni).
Il dosaggio corretto inoltre non è sempre facile da stimare con l'uso off-label, ad esempio quando i bambini devono essere trattati con un farmaco per adulti. Perché la dose e l'effetto di un farmaco non sono necessariamente proporzionali alle dimensioni corporee (altezza, peso, superficie corporea). Il semplice dimezzamento della dose per un adulto di 70 kg quando si tratta un bambino di 35 kg potrebbe essere sbagliato: la dose ridotta potrebbe non essere abbastanza efficace o ancora troppo alta per il bambino.
Quando si tratta di uso off-label, i medici di solito si orientano verso studi che indagano sull'uso di un farmaco in un'area non approvata. Questa ricerca è spesso di buona qualità e include informazioni come la dose e la durata dell'uso. In tali casi, l'uso off-label diventa meno preoccupante. Tuttavia, non sono sufficienti per ottenere l'approvazione ufficiale del farmaco per l'area di applicazione.
Uso off-label: esempi
Ci sono una serie di ingredienti attivi che i medici usano off-label. Alcuni esempi sono riportati di seguito.
Farmaci per adulti per bambini
Alcuni farmaci sul mercato sono stati testati per l'efficacia e la sicurezza solo negli adulti e sono stati approvati solo per l'uso negli adulti. Gli studi sugli adulti richiesti per l'approvazione richiedono meno tempo per le aziende farmaceutiche rispetto ai corrispondenti studi sui bambini.
Ciò significa che quando si trattano i bambini, i medici potrebbero dover ricorrere a "medicinali per adulti" perché non esistono preparati approvati corrispondenti per i bambini.
Un regolamento UE in vigore dal 2007 offre ai produttori farmaceutici, tra l'altro, incentivi speciali per immettere sul mercato medicinali per bambini, ovvero preparati il cui uso efficace e sicuro nei bambini è stato adeguatamente testato e poi approvato.
Allo stesso tempo, l'ordinanza garantisce che i farmaci siano ricercati in alta qualità e che siano adeguatamente approvati.
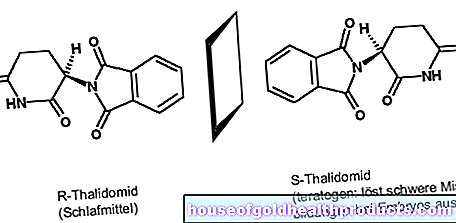
Farmaci per l'epilessia per l'emicrania
Il farmaco acido valproico ha un effetto antispasmodico ed è approvato per il trattamento dell'epilessia e dei disturbi bipolari. Secondo gli studi, può anche prevenire le emicranie, ovvero ridurre efficacemente il numero di attacchi di emicrania nei pazienti adulti.
Pertanto, in determinate condizioni, il principio attivo viene utilizzato nell'uso off-label per la profilassi dell'emicrania negli adulti. Una delle condizioni è che i farmaci approvati per la profilassi dell'emicrania non abbiano funzionato o non debbano essere utilizzati per il paziente.
Nei bambini e negli adolescenti, l'acido valproico non può prevenire l'emicrania meglio di un farmaco fittizio (placebo). Pertanto, il principio attivo non è adatto per la profilassi dell'emicrania in questo gruppo di pazienti.
Farmaci antitumorali "off label"
Ci vuole molto tempo prima che il complesso processo di approvazione di un farmaco sia completato, tempo che spesso non è disponibile quando si trattano i malati di cancro. Pertanto, l'uso off-label nella terapia del cancro non è raro:
In molti casi, gli studi presentati sull'efficacia e la sicurezza di un farmaco sono già stati verificati dall'autorità di approvazione ei risultati positivi di questo test sono già stati pubblicati, ma il processo di approvazione non è stato ancora completamente completato. Fino ad allora, il farmaco sarà spesso utilizzato come standard nella terapia del cancro e persino raccomandato nelle linee guida mediche.
Un'altra possibilità: un farmaco approvato per il trattamento del cancro ai polmoni, ad esempio, si è dimostrato efficace anche nel cancro allo stomaco. Il produttore può quindi richiedere un'estensione dell'approvazione, che a sua volta richiede molto tempo. Nel frattempo (cioè temporaneamente), i medici possono quindi utilizzare off-label il farmaco contro il cancro del polmone contro i tumori maligni dello stomaco.
A volte i produttori si risparmiano un'ulteriore approvazione lunga e costosa. Quindi può essere che l'uso off-label sia praticamente permanente.
Farmaci “off-label”: paga la cassa malati?
I pazienti di solito devono pagare di tasca propria la terapia "off-label". Le assicurazioni sanitarie obbligatorie coprono i costi solo a determinate condizioni.
Un prerequisito per questo è che gli esperti valutino positivamente l'uso off-label. Per fare ciò, controllano i dati scientifici sull'efficacia del farmaco nell'area di applicazione non approvata. Prendono anche in considerazione se la malattia è grave, quali sono le altre opzioni terapeutiche e quali sono le prospettive di successo della terapia "off-label".
Inoltre, il farmaco in questione deve avere un qualche tipo di approvazione in Germania se una compagnia di assicurazione sanitaria deve pagare l'applicazione "off-label".
Un altro prerequisito per l'assunzione dei costi è che il produttore del farmaco in questione accetti l'uso off-label, ovvero riconosca l'uso del suo farmaco nell'area di applicazione non approvata e quindi ne accetti la responsabilità. Quindi le compagnie di assicurazione sanitaria legale possono decidere di coprire i costi.
Ciò è possibile, ad esempio, per i suddetti farmaci contenenti acido valproico, per i quali i produttori hanno approvato l'uso off-label per la profilassi dell'emicrania.
Tags.: terapie Ospedale Malattie